

Амбулаторное лечение всех форм заболеваний вен по уникальным
эндоваскулярным минимально инвазивным бесшовным технологиям
|


опубликовано в журнале «Флебология» №2, выпуск 2, 2013, том 7
Российские клинические рекомендации лечения заболеваний вен: хирургическое лечениеСм. также:
8. Хирургическое лечение8.1. Прямые хирургические вмешательства8.1.1. Хирургия варикозной болезниОсновным методом лечения варикозной болезни остается хирургическое вмешательство. Целью операции является устранение симптомов заболевания, предотвращение прогрессирования варикозной трансформации подкожных вен, нарушения венозного оттока за счет устранения рефлюкса крови, ликвидация патологической венозной ёмкости, а так же устранение косметического дефекта, вызванного заболеванием. Хирургическое вмешательство в большинстве случаев включает в себя сразу несколько способов, выполняемых одновременно или поэтапно. Использование различных комбинаций методов должно быть обосновано особенностями и выраженностью патологических изменений в венозной системе. Показанием к операции служит наличие рефлюкса крови в поверхностных венах у больных с классами С2-С6. Наличие рефлюкса крови по стволам БПВ, МПВ и перфорантным венам при отсутствии варикозной трансформации подкожных вен не может быть расценено как показание к хирургическому лечению. В данной ситуации необходимо динамическое наблюдение за пациентом. В основе хирургической операции при варикозной болезни вен нижних конечностей остается комбинированная флебэктомия, которая может включать в себя следующие этапы:
8.1.1.1. Кроссэктомия и удаление ствола большой подкожной веныОптимальным для лигирования БПВ является доступ по паховой складке. БПВ должна быть лигирована пристеночно к бедренной вене, все приустьевые притоки должны быть обязательно перевязаны. Необходимости в ушивании овального окна или подкожной клетчатки после кроссэктомии БПВ нет. Ствол БПВ удаляют с помощью зондов различной конструкции. Определяя протяженность стриппинга БПВ, нужно учитывать, что в подавляющем числе наблюдений (80-90%) рефлюкс по БПВ регистрируется только от устья до верхней трети голени, таким образом у большинства пациентов оптимальным является выполнение «короткого» стриппинга - удаления ствола на протяжении от устья до уровня верхней трети голени. Удаление БПВ на всем протяжении - «тотальный» стриппинг - сопровождается достоверно более высокой частотой повреждений подкожных нервов по сравнению с удалением БПВ от устья до верхней трети голени. При этом частота рецидивов варикозной болезни существенно не отличается. Удаление неизмененного ствола БПВ на голени не рекомендуется. Остающийся сегмент вены можно в будущем использовать для реконструктивных сосудистых операций. Выбирая способ сафенэктомии, предпочтение следует отдавать инверсионным методикам (в том числе PIN-стриппингу) или криофлебэктомии. Их преимущества (меньшая травматичность) в сравнении с классической методикой Бэбкокка несомненны. Выбирая направление удаления вены, предпочтение следует отдавать тракции сверху вниз, т.е. ретроградно, за исключением криофлебэктомии, методика которой подразумевает антеградное удаление вены. 8.1.1.2. Кроссэктомия и удаление ствола малой подкожной веныХирургические вмешательства на МПВ следует проводить в положении больного на животе. Строение терминального отдела МПВ очень вариабельно, поэтому нельзя проводить ее кроссэктомию без предварительного ультразвукового обследования зоны сафено-поплитеального соустья. Перед операцией следует уточнить локализацию соустья и особенность распространения рефлюкса с помощью ультразвукового сканирования. Лигирование приустьевого отдела МПВ рекомендуется выполнять из поперечного доступа в подколенной ямке. Вену следует удалять только в тех пределах, в которых определено наличие рефлюкса. В нижней трети голени рефлюкс по МПВ встречается редко. Для удаления следует также использовать инверсионные способы. 8.1.1.3. Удаление варикозно изменённых притоков подкожных венУдаление варикозно измененных притоков БПВ и МПВ следует выполнять по методике минифлебэктомии с применением соответствующих инструментов через проколы кожи, не требующие наложения швов. В ряде случаев, по согласованию с пациентом возможно оставление некоторых варикозно измененных вен для последующей флебосклерооблитерации, лазеротерапии. Другие, ранее обсуждавшиеся хирургические способы (прошивание вен, удаление венозных притоков из отдельных разрезов) - более травматичны и приводят к худшим результатам. В условиях трофических изменений кожи и подкожной клетчатки не следует стремиться к максимально полному удалению узлов через кожные доступы. 8.1.1.4. Перевязка несостоятельных перфорантных венПоказанием к устранению перфорантных вен может служить только объективно зарегистрированный с помощью ультразвукового сканирования патологический венозный рефлюкс по ним. Объективная оценка состоятельности перфорантных вен возможна только при ультразвуковом сканировании в вертикальном положении пациента. В связи с этим, неверной следует признать сложившуюся практику исследования перфорантов в горизонтальном положении пациента. Даже при выявлении несостоятельности перфорантной вены следует принимать во внимание особенности течения заболевания у конкретного пациента, локализацию перфоранта и его характеристики. Целесообразно проводить вмешательства на венах диаметром более 3,5 мм с продолжительностью рефлюкса по ним более 0,5 сек, локализующихся в зоне открытой или зажившей трофической язвы (классы С5-С6). Во всех остальных случаях целесообразность хирургического вмешательства на перфорантных венах сомнительна, поскольку доказательств эффективности такого подхода не имеется. Кроме того, хирургам перед принятием решения об вмешательстве на перфорантных венах у пациентов с варикозной болезнью следует учитывать тот факт, что после устранения вертикального рефлюкса по стволам и притокам БПВ и МПВ, в большей части ранее несостоятельных перфорантных вен рефлюкс не регистрируется. В настоящее время основным методом устранения рефлюкса по ПВ в условиях отсутствия трофических изменений кожи является их надфасциальная перевязка, для чего следует предпочитать инструментарий для минифлебэктомии. В условиях трофических изменений кожи от разрезов в пораженной области следует воздержаться. Склерозирование или лазерная облитерация несостоятельных перфорантных вен, выполняемые под ультразвуковым контролем, являются малоинвазивными методами устранения горизонтального рефлюкса. Их применение не имеет ограничений по локализации ПВ, не требует отсрочки лечения в связи с наличием отека, индурации, атрофии кожи, выполнимо даже на фоне открытой трофической язвы. Вместе с тем, эффективность этих вмешательств в среднесрочном и отдаленном периодах изучена недостаточно. Показания к применению эндоскопической субфасциальной диссекции перфорантных вен в настоящее время значительно сузились, ее следует использовать лишь при неэффективности малоинвазивных способов или в ситуациях, когда их применение невозможно. Открытая диссекция перфорантных вен (метод Линтона-Фельдера) для пересечения несостоятельных ПВ не должна применяться в хирургии варикозной болезни в связи с высокой травматичностью и наличием альтернативных малоинвазивных методик. 8.1.1.5. Коррекция клапанов глубоких венПоказания к коррекции клапанного аппарата глубоких вен в настоящее временя находится в стадии изучения. В значительной части наблюдений при варикозной болезни полноценное устранение вертикального и горизонтального рефлюкса в поверхностных венах в сочетании с компрессионным лечением в значительной степени нивелируют клиническое значение несостоятельности клапанов глубоких вен, во многих случаях при ультразвуковом ангиосканировании фиксируют исчезновение рефлюкса. Поэтому операции на глубоких венах не следует проводить одновременно с вмешательством на подкожных и перфорантных венах. Их выполнение возможно только по строгим показаниями у пациентов с классами С5-С6 и рефлюксом по глубоким венам 3-4 степени (до уровня коленного суставаи ниже) по классификации Kistner, а так же при неэффективности всех ранее использованных методов как хирургического, так и консервативного лечения. Хирургические методы лечения первичного рефлюкса по глубоким венам можно разделить на две группы. Первая подразумевает проведение флеботомии и включает в себя внутреннюю вальвулопластику, создание новых клапанов. Вторая группа не требует флеботомии и включает экстравазальные вмешательства, наружную вальвулопластику (трансмуральную или транскоммиссуральную), ангиоскопически ассистированную экстравазальную вальвулопластику, чрескожную установку корригирующих устройств. Интравазальная коррекция клапанного аппарата предпочтительна. Операции по коррекции клапанов глубоких вен должны выполняться только в специализированных центрах, имеющих опыт подобных вмешательств. 8.2. Эндовазальная термическая облитерация (абляция)Методы термической облитерации вен основаны на эндовазальном тепловом повреждении венозной стенки, приводящем к ее окклюзии и трансформации вены в соединительно-тканный тяж, т.е. исчезновению вены как морфологической и функционирующей структуры. Для этого используется энергия электромагнитных колебаний в радиочастотном диапазоне, лазерное излучение, энергия перегретого под высоким давлением пара. Широкое внедрение методов термической облитерации в клиническую практику показало их эффективность и безопасность, что привело к значительным изменениям в организации и структуре лечения пациентов с варикозной болезнью. Применение термооблитерации позволяет обеспечить лечение большинства пациентов в амбулаторных условиях под местной анестезией. Вмешательства характеризуются минимальной травматичностью, быстрым восстановлением трудоспособности, хорошим косметическим результатом, имеют минимальное отрицательное влияние на показатели качества жизни. Современные эндовазальные методики – лазерная и радиочастотная облитерация – позволяют устранить стволовой рефлюкс и поэтому по своему функциональному эффекту могут быть названы альтернативой кроссэктомии и стриппингу. Эти вмешательства выполняют исключительно под ультразвуковым контролем от момента пункции вены до завершения процедуры. Их применение в клинической практике возможно только при наличии соответствующей аппаратуры и специальной подготовки врача. В настоящее время в России разрешены к применению радиочастотная и лазерная облитерация. 8.2.1. Показания и противопоказанияПоказания к эндовазальной термической облитерации аналогичны показаниям к применению прямых хирургических методов. Заболевания и патологические состояния, являющиеся противопоказанием для плановой традиционной флебэктомии, в настоящее время следует рассматривать в качестве противопоказаний и для термической облитерации. Различные нарушения системы гемостаза, как и факт их медикаментозного лечения, не будучи абсолютным противопоказанием для выполнения эндовазальной процедуры, требуют строгой оценки степени риска возможных осложнений. Ранняя активизация пациента после термооблитерации является важной мерой профилактики венозного тромбоза и других системных осложнений. В лечении венозных трофических язв термооблитерация нецелесообразна в период острой гнойной экссудации. Минимальная инвазивность этого вмешательства позволяет выполнить как стволовую термооблитерацию, так и облитерацию несостоятельных перфорантных вен в зоне язвы при стихании острого воспаления, не дожидаясь эпителизации язвы. Обсуждаются так называемые анатомические или «технические» противопоказания к лазерной облитерации - извитой ход и большие размеры вены, удвоение ствола, или аплазия фрагментов ствола, поверхностное подкожное расположение вены, ее аневризматическое расширение, наличие множественных приустьевых притоков. Такие особенности строения венозной системы следует диагностировать на дооперационном этапе, они могут значительно затруднить выполнение процедуры, но с набором опыта, не могут служить преградой для выполнения термооблитерации. В настоящее время разработаны специальные технологии и инструменты для выполнения эндовазальной облитерации в сложных анатомических и технических условиях. 8.2.2. Общие принципы эндовазальной термооблитерации
8.2.3. Особенности проведения лазерной облитерацииДля эффективной облитерации на аппаратах с излучением в диапазоне 810-1064 нм нужно использовать энергию из расчета 10 Дж на каждый мм диаметра вены, измеренного в вертикальном положении пациента. Т.о. линейная плотность энергии обычно составляет 70–120 Дж на каждый 1 см вены. Для доставки такой энергии используется мощность, как правило, от 10 до 15 Вт, при скорости извлечения световода 1 см. за 7-10 секунд (1-2 мм/сек). При использовании лазерных аппаратов, работающих в диапазоне 1470–1560 нм используют энергию излучения 6-7 Дж на каждый мм диаметра вены, т.о. линейная плотность энергии обычно составляет 30–80 Дж на 1 см длины вены. Для доставки такой энергии используют, как правило, мощность 5-10 Вт, при скорости извлечения световода 1 см за 7-10 секунд (1-2 мм/сек). Время воздействия определяется формулой t = (LEED)/P , где t – время излучения, LEED – линейная плотность энергии, P – мощность излучения. 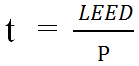 Перед началом работы целесообразно измерение мощности излучения на рабочем конце оптического волокна. Применение лазерного световода с радиальной эмиссией имеет преимущества перед другими видами световодов за счет лучшего распределения энергии внутри вены. Выбор режима излучения определяется предпочтением врача. Учитывая необходимость длительной равномерной тракции световода, возможно применение специальных аппаратов для автоматической программируемой тракции оптического волокна. 8.2.4. Особенности проведения радиочастотной облитерацииПри проведении радиочастотной облитерации следует придерживаться следующих правил. Конец катетера располагают в приустьевом отделе дистальнее проксимального притока и проводят воздействие не менее двух энергетических циклов. На бедре для воздействия на ствол БПВ проводят 1-2 цикла, на уровне колена и на голени – по 1 циклу на сегмент. При диаметре магистральной вены более 10 мм допустимо использование более 1 цикла. Для воздействия на ствол МПВ используют по 1 циклу на сегмент. 9.2.5. Профилактика венозных тромбоэмболических осложнений после термооблитерацииНаиболее тяжёлым осложнением термооблитерации является развитие тромбоза глубоких вен, обусловленных продолженным ростом тромботической окклюзии БПВ или МПВ проксимальнее соустья. Т.н. термоиндуцированные тромбозы встречаются менее чем в 7-8% наблюдений. Они могут возникать даже при строгом соблюдении технологии облитерации, которая сопровождается термическим повреждением венозной стенки и формированием окклюзивного тромбоза на значительном протяжении. Хотя вопрос о необходимости назначения антикоагулянтов после термооблитерации не имеет однозначного решения в мировой литературе, сопоставляя риск лечения и возможных осложнений, следует признать более правильным проведение профилактики ВТЭО у больных с умеренным и высоким риском с использованием профилактических дозировок низкомолекулярных гепаринов или фондапаринукса в течение 4-5 дней. 8.3. Хирургическое лечение посттромботической болезниХирургические вмешательства при ПТБ является составной частью комплексного лечения этого заболевания, но не могут привести к полному клиническому выздоровлению. В настоящее время в качестве показания к хирургическому вмешательству при ПТБ следует рассматривать отсутствие эффекта от комплексного консервативного лечения, проявляющееся в развитии трофической язвы. Хирургическое вмешательство может быть направлено либо на ускорение заживления трофической язвы (пациенты с классом С6), либо на предотвращение ее рецидива (пациенты с классом С5). Относительным показанием к хирургическому вмешательству может служить стойкий отёк или начинающееся формирование трофических расстройств у пациентов с окклюзией или стенозом подвздошных вен. Хирургические вмешательства при ПТБ направлены на:
Стандартного набора операций в лечении ПТБ не существует. Точка приложения и метод выбираются строго индивидуально, исходя из клинической симптоматики, результатов обследования пациентов с помощью ультразвукового ангиосканирования, а при необходимости – с учётом данных рентгеноконтрастной флебографии, радиоизотопной флебографии. КТ-ангиографии, МР-ангиографии. Следует придерживаться определённой последовательности применения хирургических методов. Так, первоочередной задачей хирургического лечения при ПТБ является восстановление проходимости проксимальных венозных сегментов (нижняя полая вена, подвздошные вены, бедренные вены, подколенная вена). Для этой цели используют хирургическую открытую дезобструкцию, эндоваскулярную ангиопластику со стентированием, шунтирующие операции (операция Пальма-Эсперона). 8.3.1. Шунтирующие вмешательства и восстановление проходимости глубоких венОперация Пальма-Эсперона (перекрёстное бедренно-бедренное аутовенозное шунтирование) показана при односторонней окклюзии подвздошных вен. Обязательным условием является отсутствие посттромботических изменений в венах контралатеральной стороны и наличие аутовены не менее 6-7 мм В ряде случаев для обеспечения проходимости шунта, профилактики его тромбоза, предотвращения ретромбоза реканализованной вены возникает необходимость в создании искусственной артерио-венозной фистулы (временной или постоянной, в проксимальном или дистальном сегментах). Показания к ее созданию остаются предметом дискуссий. Проходимость подвздошных вен при их окклюзии или гемодинамически значимом стенозе может быть восстановлена эндоваскулярной ангиопластикой со стентированием. При этом следует отметить, что критерии гемодинамически значимого (критического) стеноза четко неопределены, а эффективность эндоваскулярных вмешательств в отдаленном периоде недостаточно изучена. В ближайшем периоде после стентирования удается достигнуть восстановления проходимости подвздошных вен почти в 100% наблюдений. В дальнейшем сохраняется риск ретромбоза и окклюзии стентированного участка, особенно у пациентов с протяженной окклюзией и тромбофилией. 8.3.2. Вмешательства на подкожной венозной системеПодкожные вены при ПТБ у многих пациентов выполняют коллатеральную функцию и их удаление может привести к ухудшению течения заболевания. В связи с этим при ПТБ флебэктомия (а также лазерная или радиочастотная облитерация) не может использоваться в качестве рутинной процедуры. Решение о необходимости и возможности удаления подкожных вен в том или ином объеме должно приниматься на основании тщательного анализа клинических и анамнестических сведений, результатов инструментальных диагностических тестов. Условиями для выполнения флебэктомии при ПТБ является проходимость проксимальных отделов глубокого венозного русла (бедренных и подвздошных вен), наличие выраженного варикозного синдрома, патологического рефлюкса по БПВ, МПВ, их притокам, и уверенность в том, что планируемые к удалению вены исчерпали свою обходную роль. Комментарий. На фоне не подлежащих коррекции изменений в глубоких венах возможность долгосрочного эффекта от вмешательств на подкожных венах при ПТБ оперативного лечения весьма сомнительна. Появление новых несостоятельных подкожных и перфорантных вен в отдаленные сроки после операции не является редкостью. Пациент должен быть обязательно проинформирован об этом. 8.3.3. Вмешательства на перфорантных венахРефлюкс по перфорантным венам у пациентов с ПТБ развивается в первые недели после острого венозного тромбоза, обеспечивая тем самым коллатеральный кровоток по подкожным венам. Со временем, при истощении компенсирующей функции поверхностных вен, перфорантный рефлюкс приобретает патологическую роль и может требовать устранения. Показанием к вмешательству на перфорантных венах у пациентов с ПТБ является наличие зажившей или открытой трофической язвы (класс С5-С6). Методом выбора на сегодняшний день следует признать лазерную или радиочастотную облитерацию в силу их минимальной инвазивности. Применение эндоскопической техники для устранения несостоятельных перфорантных в области задней и медиальной поверхности голени возможно у пациентов классов С5-С6 при недоступности эндовазальных методов облитерации перфорантных вен. Операция типа Линтона, как способ коррекции несостоятельности ПВ голени, в настоящее время должна быть исключена из арсенала хирургии ПТБ. 8.3.4. Коррекция несостоятельности клапанного аппарата глубоких вен, трансплантация и транспозиция сегментов вен с нормально функционирующими клапанамиПосттромботическое поражение клапанного аппарата в большинстве случаев не поддаётся прямой хирургической коррекции. Предложены различные варианты создания искусственных клапанов. Эффект этих операций часто непредсказуем, поэтому показания к ним требуют тщательного обсуждения и обычно возникают при:
Наличие окклюзивного поражения в проксимальных отделах служит препятствием для операций по коррекции клапанной недостаточности глубоких вен. При неэффективности хирургической вальвулопластики можно рассмотреть возможность трансплантации или транспозиции вен с функционирующими клапанами. Для трансплантации обычно используют вены верхней конечности, которые пересаживают в позицию бедренной вены. Технические сложности и ограничения обусловлены существенной разницей в диаметрах вен. Трансплантация сегментов вен, содержащих клапаны, демонстрирует хорошую эффективность в ближайшие месяцы после операции. В отдаленном периоде возможна дилятация трансплантированных сегментов с возобновлением рефлюкса. Вызывают сомнение компенсаторные возможности фрагмента с замещенными клапанами при протяженном поражении глубокой венозной системы. Транспозиция вен имеет целью направление тока крови по сегменту магистральной вены с нормально функционирующими клапанами. Так, при наличии интактной БПВ формируют анастомоз между БПВ и ПБВ после ее резекции. В других случаях, учитывая редкое поражение клапанного аппарата глубокой вены бедра, предложено формирование анастомоза между резецированной ПБВ и глубокой веной бедра дистальнее ее состоятельного клапана. Оптимальные условия для выполнения этих операций встречаются достаточно крайне редко. Небольшое количество наблюдений и отсутствие анализа отдаленных результатов не позволяют оценить эффективность этих операций и рекомендовать их в практику. 8.4. Хирургическое лечение флебодисплазийЛечение пациентов с венозными формами дисплазий должно осуществляться на принципах междисциплинарного подхода, который предусматривает как тщательную диагностику на основе преимущественно неинвазивных методов, так и интеграцию хирургических и нехирургических методов в лечении:
Чрезвычайная вариабельность клинической симптоматики при этих формах поражения заставляет индивидуализировать в каждом конкретном случае лечебную тактику. Показаниями к хирургическому лечению венозных дисплазий служат:
Эффективных методов радикальной коррекции гемодинамики у пациентов с флебодисплазиями не существует. Основным методом хирургического лечения является иссечение конгломератов вен с целью уменьшения локального венозного застоя. У пациентов с обструктивным поражением глубоких вен, операция направлена на улучшение оттока крови. В настоящее время получены положительные результаты от лечения определенного типа дисплазий с помощью пенной склеротерапии, а локальные патологические образования капиллярной природы могут успешно лечиться с использованием лазерных систем. * * * Операции по поводу ХЗВ могут выполняться в амбулаторных и/или стационарных отделениях хирургами или ангиохирургами, прошедшими подготовку по флебологии. Операции на глубоких венах являются прерогативой сосудистых хирургов. Некоторые виды вмешательств (реконструктивные: вальвулопластика, шунтирование, транспозиция, трансплантация) должны проводиться только в специализированных центрах по строгим показаниям. |
 |
Powered by WSM 3.0 |
© 2012-2020 Шайдаков Евгений Владимирович |